El pasado 3 de marzo el Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (CECMED) dio la autorización para que uno de los candidatos vacunales cubanos que se encuentran desarrollándose comenzara la fase III de ensayos clínicos en humanos. Varios de los principales medios del mundo: The New York Times, CNN, BBC, El País reportaron la noticia. Y es que Cuba se incluye en una pequeña lista de países —casi todos del primer mundo— que han podido desarrollar candidatos vacunales contra el SARS-Cov-2, y el primer país de América Latina en llegar a esta fase avanzada de ensayos.

Para ser aprobadas las vacunas deben seguir un estricto protocolo que incluye la etapa de exploración, la de ensayos pre-clínicos y la de ensayos clínicos en humanos, esta última, a su vez consta de tres fases.
La aprobación final para el uso de vacunas en humanos la otorgan órganos reguladores en cada país. Estos deben tener la condición de Autoridad Competente para el sistema regulador de vacunas otorgada por la Organización Mundial de la Salud (OMS).
¿Qué ha pasado con las vacunas contra la COVID-19 y qué es una aprobación para uso en emergencia?
Como nunca en la historia de la ciencia y la salud la comunidad científica —entidades públicas, privadas, centros de investigación, universidades, farmacéuticas, empresas y ONG— ha colaborado para lograr una cura ante una crisis pandémica. Se han publicado sobre este tema más de 100 000 artículos científicos. Existen registrados más de 4 800 estudios en curso sobre tratamientos y vacunas. Sabemos más sobre el SARS-CoV-2 y la COVID-19 que de otras enfermedades que la comunidad científica lleva lustros estudiando.
Según la OMS, hasta el día 5 de marzo contra la COVID-19 existían 79 candidatos vacunales en ensayos clínicos y 182 en ensayos pre-clínicos. De ellos varios han sido aprobados por los órganos reguladores de algunos países y dos vacunas (Pfizer y AstraZeneca/Oxford) cuentan con la aprobación para uso de emergencia de la OMS.
El desarrollo y aprobación de una vacuna usualmente es un largo proceso que puede tardar entre 5 y 15 años, por eso muchos se sorprenden de que a poco más de un año del inicio de lo que se convirtió en la pandemia de COVID-19, ya existan vacunas contra la enfermedad.
Varios factores han influido para que esto suceda: la prioridad que se le ha dado, la colaboración entre la comunidad científica internacional, logro de rápidos financiamientos, la respuesta de los organismos reguladores para rediseñar protocolos que permitan el solapamiento de algunas fases, y el desarrollo alcanzado por la biotecnología en el mundo.
Los organismos reguladores de cada país y la OMS han diseñado y aprobado protocolos acelerados para estas vacunas que han permitido solapar las fases, o sea, con resultados parciales positivos han podido avanzar a la fase siguiente sin haber concluido completamente la anterior. Por otra parte, se han acortado o suprimido las pausas entre cada paso del desarrollo que, por lo general, es necesario realizar para obtener más financiación. Como se hace con todas las vacunas las desarrolladas contra la COVID-19 deben pasar por un proceso riguroso con varias fases que incluyen, por ejemplo, amplios ensayos de fase III con decenas de miles de personas. La OMS ha confirmado que se han respetado los criterios más exigentes y los controles requeridos.
Los fabricantes de vacunas contra la COVID-19 suscribieron un compromiso conjunto de no solicitar ante los gobiernos la autorización de sus vacunas hasta que se demuestre su inocuidad y su eficacia, según ha informado la OMS.
Uso de emergencia
Las entidades reguladoras pueden, y lo han hecho en este caso, aprobar medicamentos y vacunas para uso durante emergencias médicas sin seguir el protocolo habitual que es más demorado, pero esto no significa que puedan saltarse pasos necesarios, una aprobación de este tipo requiere un protocolo —más rápido— pero extremadamente riguroso. Tanto la OMS como los organismos reguladores de cada país establece su protocolo para ello y aprueba los candidatos que lo cumplan.

CANDIDATOS VACUNALES CUBANOS
De los 79 candidatos vacunales en ensayos clínicos registrados por la OMS hasta el 5 de marzo, cuatro son cubanos: dos desarrollados por el Instituto Finlay de Vacunas (IFV) y otros dos por el Centro de Ingeniería Genética y Biotecnología (CIGB), uno de ellos (Soberana 02) se encuentra entre los 23 que han llegado a la fase III.

Los cinco candidatos vacunales cubanos son del tipo de vacuna de subunidad1, en todos los casos se utiliza el dominio de unión al receptor (RBD)2como antígeno para provocar la respuesta inmune específica contra el virus que causa la COVID-19.
Una de las ventajas de los candidatos vacunales cubanos es que requieren una refrigeración de entre 8 °C y 2 °C —a diferencia de las vacunas del tipo ADN/ARN que deben ser conservadas a temperaturas mucho más bajas, lo cual complica la transportación.
Los candidatos vacunales desarrollados por el Instituto Finlay utilizan el antígeno RBD expresado en células de mamíferos superiores; mientras que Mambisa y Abdala, desarrolladas por el CIGB, usan el antígeno expresado en levadura pichia pastoris. Ambas plataformas son utilizadas por otras vacunas cubanas de amplia distribución y comprobada efectividad. La Mambisa, por su parte, tiene la particularidad de ser un spray nasal.
SOBERANA 02
El candidato vacunal Soberana 02 (FINLAY-FR-2) es una vacuna conjugada (un antígeno se fusiona con una molécula portadora para reforzar su estabilidad y eficacia) en la cual el RBD (antígeno) se une químicamente a la toxina del tétanos (molécula portadora).

Algunos resultados:
En las fases I y II de ensayos clínicos se evalúa la seguridad y la inmunogenicidad del candidato vacunal. La seguridad tiene que ver con los efectos adversos que pueda desarrollar la persona vacunada y la inmunogenicidad con la capacidad de la vacuna de generar una respuesta inmune (haciendo hincapié en los anticuerpos) en la persona inoculada que consiga protegerla contra la enfermedad.
Seguridad:
Fase I: De los 40 sujetos vacunados se detectaron 23 eventos adversos (ninguno grave)
Fase II: De los 910 sujetos vacunados el 39,4% reportó algún efecto adverso, de estos el 40% fue dolor en el sitio de vacunación que es un efecto esperado.
Inmunogenicidad:
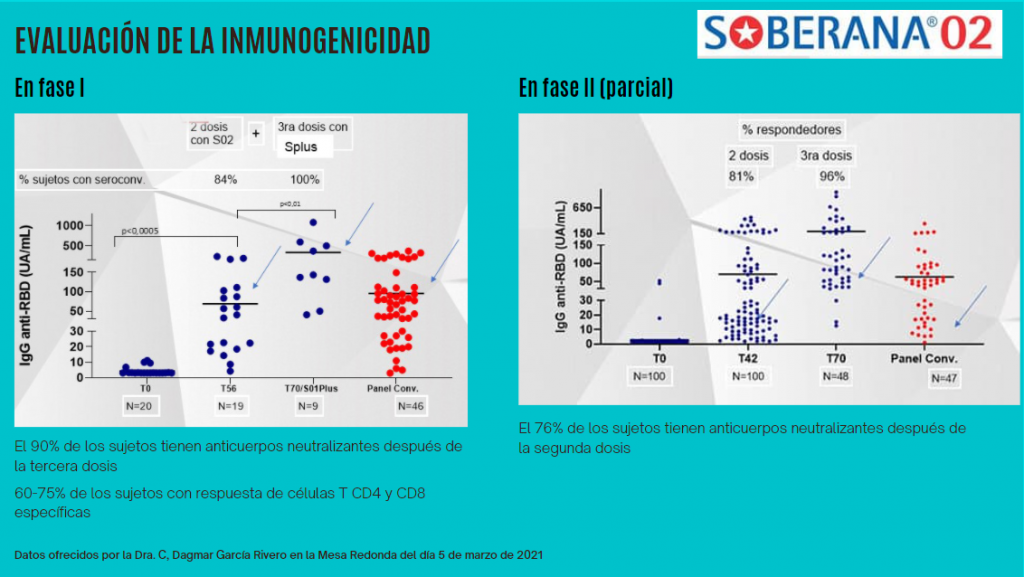
En la fase I se comprobó que después de la segunda dosis el 84% de los individuos eran respondedores (presencia en el suero de anticuerpos contra COVID-19).
Los investigadores decidieron añadir una tercera dosis, a la mitad de los individuos los vacunaron con una tercera dosis de Soberana 02 y a la otra mitad con una nueva formulación: Soberana Plus.
Se detectó que después de la tercera dosis el 100% de los individuos eran respondedores, y en el 90% lograron producir una respuesta de anticuerpos neutralizantes. Esto quiere decir que no solo se detectaron niveles de anticuerpos contra el SARS-Cov-2, sino que los anticuerpos del 90% de los individuos lograron in vitro neutralizar la entrada del virus a la célula. Esta es la respuesta que más se busca en esta fase.
Entre el 60-75% de los individuos desarrollaron una respuesta de células T significativa, lo cual refuerza la respuesta del sistema inmune provocada por la vacuna.
En la fase II el 81% de los individuos fueron respondedores después de la segunda dosis (76% con anticuerpos neutralizantes) y el 96% fueron respondedores después de la tercera dosis.
Estos resultados son realmente alentadores, los investigadores compararon el suero de los vacunados con sueros de personas que habían padecido la enfermedad y se habían recuperado y la respuesta de anticuerpos era muy similar después de la segunda dosis (resultado que es el que se busca, que la vacuna logre activar el sistema inmune como ocurre de manera natural para superar la enfermedad), pero después de la tercera dosis la respuesta de los vacunados fue significativamente superior (resultado relevante).
Fase III
Con estos excelentes resultados el candidato vacunal cubano pasa a fase III de ensayos clínicos, según la Dra.C Dagmar García Rivero, directora de Investigaciones del Instituto Finlay de Vacunas este será el ensayo clínico más complejo al que se tendrá que enfrentar la ciencia cubana, por el tamaño de la muestra, su complejidad metodológica y operacional, y porque se desarrolla en medio de la epidemia. Según confirmó la científica Cuba cuenta ya con dos lotes de Soberana 02 producidos a gran escala que significan un total de 320 000 dosis.
Se trata de un ensayo fase III multicéntrico, adaptativo y en grupos paralelos, aleatorizado, controlado con placebo y a doble ciego, en voluntarios de edades comprendidas entre 19 y 80 años, sin historia conocida de infección por SARS-CoV-2.


¿Qué quiere decir que es un ensayo controlado por placebo?
Significa que un porciento de la muestra va a ser el grupo control con el que se van a comparar los resultados de las personas a quienes se inoculará el candidato vacunal. En este caso se utilizará como placebo la misma preparación del candidato vacunal sin la subunidad RBD (la porción de la vacuna que estimula la respuesta específica contra el SARS-Cov-2).
¿Qué quiere decir que será doble ciego?
Significa que ni los que reciben la inoculación, ni quienes la administran, ni quienes evalúan la respuesta de cada persona, sabrán a quiénes se les inoculó el placebo y a quiénes el candidato vacunal. Solo los investigadores que analizarán los resultados sabrán la composición de los grupos.
¿Qué ocurrirá con el grupo placebo?
Según la Dra. C. María Eugenia Toledo Romaní del Instituto de Medicina Tropical Pedro Kourí (IPK), investigadora principal del ensayo clínico Soberana 02, una vez transcurrido el período de seguimiento el grupo de personas que hayan estado incluidos en el grupo placebo recibirán la que haya resultado ser la mejor formulación de la vacuna.
Dos esquemas de vacunación:
Se evaluarán dos esquemas de tratamiento:
- Dos dosis de la vacuna Soberana 02 en intervalo de 28 días.
- Tres dosis (dos de Soberana 02 y una tercera de Soberana Plus en intervalos de 28 días)
Ambos esquemas llevarán un seguimiento de tres meses después de transcurridos 14 días de la última inmunización.
Los objetivos de esta fase serán evaluar:
- Seguridad e inmunogenicidad
- Si la vacuna logra evitar la enfermedad sintomática
- Si la vacuna logra evitar que se desarrollen formas graves de la enfermedad y la muerte
- Duración de la enfermedad
- Si la vacuna logra prevenir la infección
¿Qué es Soberana Plus?
El candidato vacunal Soberana 01 es una formulación conjugada que tiene el RBD como antígeno y como adyuvante el sistema de vesícula de membrana externa del meningococo y la alúmina (la base de VA-MENGOC, vacuna antimeningocócica BC). Soberana Plus es una variante de esta formulación sin la vesícula de membrana externa del meningococo, utilizando la alúmina como adyuvante.
¿Cuánto durará esta fase?
Como se ha hecho en el resto de los candidatos vacunales que han llegado a fase III y siguiendo la recomendación de la OMS durante este ensayo se realizarán análisis interinos, dijo el Lic. Yury Valdés Balbín, director adjunto del IFV. “Los resultados parciales de estos ensayos pueden ser utilizados para avanzar en otras categorías como el autorizo de uso de emergencia. Eso es lo que ha hecho todo el mundo, y lo que nosotros tenemos concebido en nuestro estudio”.
Es importante señalar que las diferentes pruebas para medir las respuestas de los individuos participantes no las realiza el propio Instituto Finlay, sino el Laboratorio de la Defensa Civil y el Centro de Inmunología Molecular (CIM), lo cual es otra fortaleza a la hora de ser auditados por organismos internacionales y por el propio CECMED con vistas a la aprobación del candidato vacunal.
Sean cuales sean los resultados que se vayan obteniendo en las pruebas parciales la fase III debe realizarse completa y tiene un tiempo de duración aproximadamente de tres meses, a partir de que se ponga la última dosis del tercer grupo.
¿Cuáles son los momentos de corte?
En la fase III de la vacuna el indicador más importante a medir es la eficacia, o sea, la capacidad que tenga la vacuna de prevenir que las personas vacunadas se enfermen (desarrollen síntomas).
Cuando empezó la carrera para obtener vacunas preventivas contra la COVID-19 la comunidad científica valoraba que obtener vacunas con un 50% de eficacia sería un logro. La mayoría de las vacunas contra la gripe, por ejemplo, tienen una efectividad que ronda el 40% y aun así previenen muchas muertes anualmente.
Para poder hacer un ensayo clínico fase III en un lugar específico hay que tener en cuenta varios factores, entre ellos la tasa de incidencia de la enfermedad en ese lugar. Según los científicos cubanos, este indicador en La Habana hace posible realizar el ensayo en esta provincia en estos momentos.
Según el doctor Vicente Vérez Bencomo, director general del Instituto Finlay de Vacunas, el ensayo cubano tiene diseñado tres cortes que dependerán de la cantidad de enfermos que aparezcan entre los participantes: los cortes se prevén sean de 53, 106 y 159 casos.
“La muestra total es de 159 casos al final del ensayo. Cuando aparezcan los primeros 53, se hace un corte y se evalúa. Si su vacuna es muy buena y los 53 aparecen en el placebo, ahí mismo usted puede detener el ensayo y decir que la vacuna es 100 % eficaz”, detalló.
“Si en ese primer corte hay una relación de placebo contra vacuna con la cual 53 no es suficiente, hay que seguir, hasta que aparezcan 106, y ahí se hace un segundo corte. Y luego hasta que aparezcan 159. Esos son los tres momentos decisivos del estudio. Nosotros estamos diseñando otros estudios de eficacia y hay otras formas de evaluar la eficacia y la efectividad de una vacuna. Ahora preferimos concentrarnos en la fase III convencional y cuando avancemos un poco más hacia la autorización de estos otros ensayos, explicaremos de qué se trata. De lo que hablamos es que en ningún caso vamos a comenzar a utilizar la vacuna sin demostrar su real eficacia”, dijo.
Por lo tanto, el tiempo que puede transcurrir para avanzar a otras etapas, como puede ser la solicitud de aprobación para uso de emergencia, dependerá de los resultados que se vayan obteniendo en la medida que avance el ensayo. Es un esquema de vacunación largo, el de tres dosis requiere de aproximadamente 3 meses para completarse y las evaluaciones de eficacia se comienzan a realizar 14 días después de la última inoculación. Considerando esto, los resultados irán apareciendo hacia el tercer trimestre del año.
Eficacia y efectividad en vacunas
El Centro de Control de Enfermedades de Estados Unidos (CDC, por sus siglas en inglés), refiere que “la eficacia y la efectividad de una vacuna miden la reducción proporcional de casos entre las personas vacunadas”. El término eficacia se usa cuando se refiere a “un estudio que se lleva a cabo en condiciones ideales, por ejemplo, durante un ensayo clínico”. El término efectividad es el que se emplea en “un estudio que se lleva a cabo bajo las condiciones ambientales típicas, es decir, menos controladas”.
Por eso, como ha reiterado la investigadora principal del ensayo clínico Soberana 02, Dra. María Eugenia Toledo, es muy importante que la fase III tenga un diseño que trate de parecerse lo más posible a la realidad, en cuanto a composición de la muestra y condiciones en las que se lleve a cabo.
Cuando decimos que un candidato vacunal demostró una eficacia en fase III del 96%, por ejemplo, quiere decir que, al enfermarse un número significativo de participantes en el ensayo, solo el 4% pertenecía al grupo de los vacunados.
En las vacunas contra la COVID-19, la última cifra conocida fue el 92% de eficacia que un artículo publicado en la revista científica The Lancet atribuye a la vacuna rusa Sputnik-V, que se suma al 95% reportado por la desarrollada por Pfizer-BioNtech, el 94,1% de la de Moderna y el 70% de la de la Universidad de Oxford y AstraZeneca.
Capacidad productiva para Soberana-02
Respecto a la capacidad productiva asociada al proceso, Eduardo Ojito Magaz, director general del Centro de Inmunología Molecular (CIM) precisó que “todo el producto necesario asociado a la fase III de este ensayo ya fue fabricado y liberado”.
El científico puntualizó que el CIM y el Instituto Finlay se están preparando para producir a escalas superiores:, entre un millón y dos millones de dosis mensuales y “eso nos debe permitir estar vacunando al país dentro de seis meses aproximadamente”.
Según el sitio Our World in Data hasta el día 6 de marzo se habían administrado 211.73 millones de dosis de vacunas contra la COVID-19 en el mundo, fundamentalmente en países desarrollados. Hay que tener en cuenta que la mayoría de las vacunas aprobadas hasta el momento necesitan dos dosis de administración, por lo que ese número no se corresponde con la cantidad de personas inmunizadas.
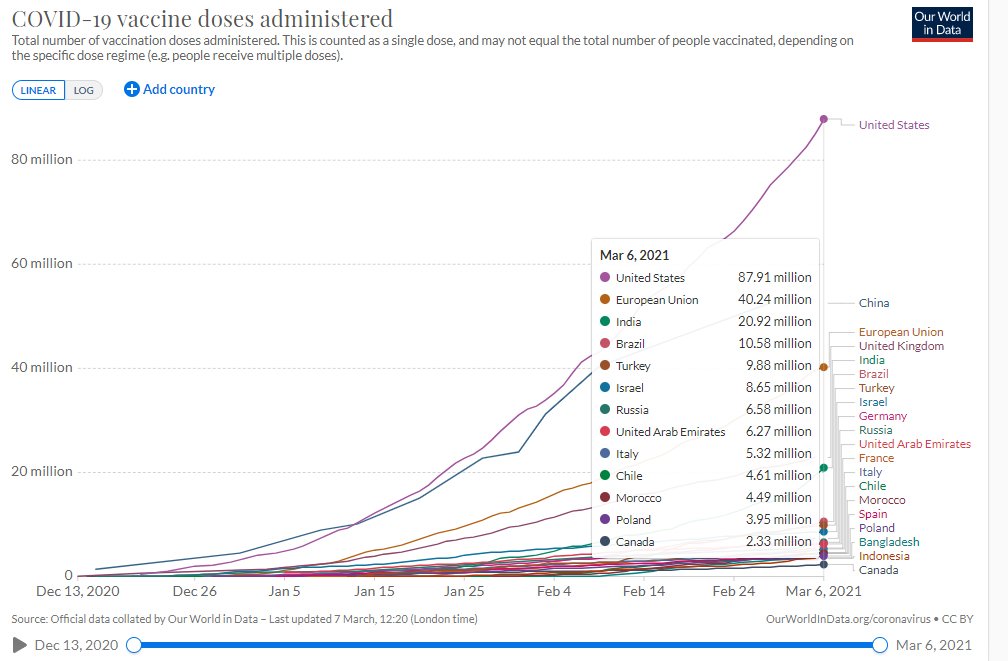
Hasta el día 7 de marzo se habían reportado en el mundo 117 279 487 casos positivos al coronavirus y 2 602 555 personas han muerto por esta causa. Algunos científicos afirman que se necesitará vacunar el 75% de la población mundial para lograr la inmunidad, el porciento que se ha inmunizado hasta ahora es mínimo por lo que faltarían muchos millones de dosis más para lograrlo.
La estrategia cubana de desarrollar varios candidatos vacunales es la más efectiva, pero está al alcance de muy pocos países en el mundo. El candidato vacunal Abdala, también una vacuna de subunidad que contiene la RBD expresada en levaduras (plataforma utilizada por la vacuna recombinante cubana contra la hepatitis B que pertenece al esquema de vacunación nacional) ha mostrado también resultados muy positivos en las fases I y II y el 3 de marzo entregó el expediente de solicitud al CECMED para iniciar fase III que, de ser aprobado, se realizará en Santiago de Cuba y Guantánamo. Según informó la Dra. Verena Muzio González, directora de Investigaciones Clínicas del Centro de Ingeniería Genética y Biotecnología (CIGB) se prevé para la fase III de este candidato la participación de 42 000 sujetos y se evaluarán esquemas de vacunación más cortos que los empleados en Soberana 02. Se probarán dos esquemas de tres dosis cada uno (0-14-28 días) y (0-28-56 días). Esto hace que, de ser aprobado el ensayo pronto, los resultados de Abdala pudieran ir apareciendo incluso antes que los de Soberana 02.
Sin dudas la ciencia y el sistema de salud cubanos están próximos a alcanzar uno de sus más loables resultados. En medio de una grave crisis económica y el consabido embargo/bloqueo estadounidense a la Isla, que lejos de flexibilizarse se ha endurecido durante la pandemia, Cuba podría convertirse en uno de los primeros países del mundo en vacunar completamente a su población —con una vacuna propia— y la biotecnología cubana prepara condiciones para producir vacunas a gran escala que podrían salvar la vida de millones de personas en el mundo.
***
Notas:
1 Entre los tipos de vacunas que se están desarrollando contra la COVID-19 destacan los siguientes tipos: virus inactivado, las que utilizan un vector viral, las que utilizan el ADN o ARN viral y las de subunidad. Estas últimas utilizan fragmentos inocuos de proteínas o estructuras proteínicas del virus causante de la COVID-19, con el fin de generar una respuesta inmunitaria.
2 El virus SARS-Cov-2, causante de la COVID-19, tiene una proteína en su envoltura (la famosa Spike protein (S), proteína Espiga) que se “une” a un receptor en las células respiratorias y digestivas humanas. Al parecer la unión entre el virus y la célula está determinada por una subunidad de la proteína S conocida como dominio de unión al receptor (RBD), esa sería la famosa “llave” que abre la célula para que el virus entre y se multiplique y tiene una gran relevancia en la capacidad de multiplicación viral. La idea de las vacunas cubanas entonces es generar anticuerpos que inhiban la entrada del virus a las células.
