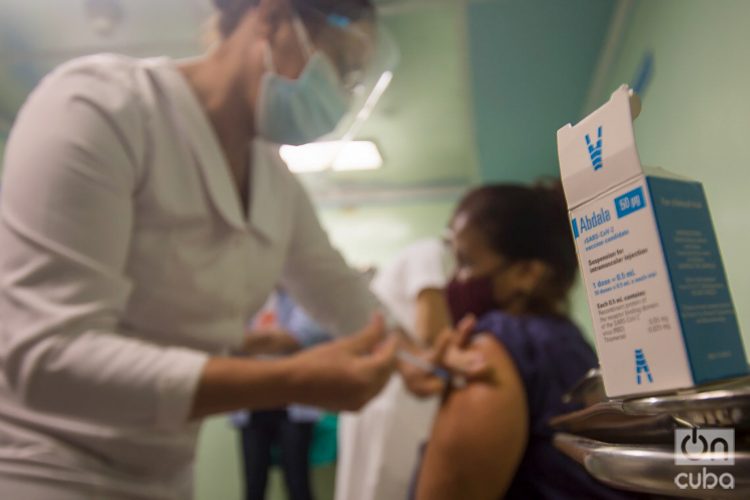
El Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos (Cecmed) otorgó este viernes el Autorizo de Uso de Emergencias a Abdala 50 µg, que se convierte en la primera vacuna anticovid-19 desarrollada en un país latinoamericano que recibe semejante aprobación.
De conformidad con lo dispuesto en las regulaciones y disposiciones vigentes, una vez confirmado que se cumple con los requisitos y parámetros exigidos en cuanto a calidad, seguridad y eficacia para este tipo de trámite, la autoridad reguladora cubana dio el visto bueno para la vacunación en la Isla con el fármaco desarrollado por el Centro de Ingeniería Genética y Biotecnología (CIGB), informó Cubadebate.
— CECMED (@cubacecmed) July 9, 2021
El Cecmed hizo efectiva la aprobación mediante la Resolución No. 113 de fecha 9 de julio del año 2021, luego de “concluir un riguroso proceso de evaluación del expediente presentado” para la solicitud del Autorizó de Uso de Emergencia y haber realizado las inspecciones a las plantas involucradas en el proceso productivo del inyectable, indica la fuente.
La entidad regulatoria asegura que confirmó los datos obtenidos en los ensayos clínicos Fase I y Fase II concluidos, además del de Fase III, aún en ejecución, que ha demostrado una eficacia en la prevención de formas sintomáticas de la enfermedad del 92.28%.
Citado por la fuente, el Cecmed añade que se verificó un adecuado perfil de seguridad de Abdala, avalado en la cantidad de dosis aplicadas a los voluntarios los ensayos clínicos, así como en el estudio de intervención con el fármaco en personal de la salud y la intervención sanitaria en poblaciones y territorios de riesgos que se lleva a cabo en la Isla.
Abdala tiene una eficacia del 92.28% con un esquema de tres dosis aplicadas, según arrojan los estudios clínicos del inmunógeno, difundidos en junio por el Centro de Ingeniería Genética y Biotecnología (CIGB).
Candidato vacunal cubano Soberana 02 muestra eficacia del 62 % en ensayos clínicos
Con estos resultados, Abdala pasará a considerarse oficialmente una vacuna contra el nuevo coronavirus, toda vez que los requisitos exigidos por la Organización Mundial de la Salud (OMS) para su aprobación establecen un 50% de eficacia para el registro de vacunas y para la autorización de uso de emergencia.