Rusia registró este miércoles un nuevo fármaco que pretende frenar la reproducción de todas las variantes conocidas del coronavirus SARS-Cov-2, en coincidencia con la autorización en Estados Unidos de la primera pastilla contra la COVID-19, que busca reducir el número de hospitalizaciones y muertes en un momento en el que la variante Ómicron ha producido un notable aumento de los contagios.
La Administración de Alimentos y Fármacos (FDA, en inglés), el ente regulador de EEUU, anunció la autorización de emergencia de la píldora de Pfizer, que también fue avalada este mes por la Agencia Europea de Medicamentos (EMA), aunque todavía no la ha autorizado oficialmente.
Reseña la agencia EFE que en su comunicado la FDA especificó que la pastilla puede usarse para tratar casos moderados de coronavirus en adultos y menores de 12 años con al menos 40 kilogramos de peso y que tengan condiciones previas, como obesidad o problemas de corazón, que les ponga en riesgo de ser hospitalizados.
La pastilla de Pfizer es el primer tratamiento oral anticovid que los estadounidenses podrán tomar en sus casas y se espera que se convierta en una herramienta crucial contra la pandemia, en un momento en el que los casos se han disparado por la variante Ómicron.
Hasta ahora, todos los tratamientos en EEUU contra la enfermedad se administraban a través de una inyección o por vía intravenosa.
La pastilla, que se venderá con el nombre de Paxlovid, solo podrá ser comprada con receta médica y los pacientes deben tomarla tan pronto como sepan que tienen la enfermedad, como máximo dentro de los cinco primeros días en los que hayan presentado síntomas, detalló la FDA en su comunicado, citado por EFE.
Según los expertos de Pfizer, la píldora funciona bloqueando la actividad de una encima específica que el coronavirus necesita para replicarse en el cuerpo infectado, un mecanismo similar al de la pastilla desarrollada por otra gran farmacéutica, MSD (Merck en EE.UU. y Canadá).
Se espera que la FDA también dé pronto su visto bueno a esa pastilla, aunque los datos muestran que la de Pfizer es más efectiva y tiene menos efectos secundarios.
En concreto, el ensayo clínico de Pfizer muestra que la pastilla redujo en un 89 % de los casos las muertes y hospitalizaciones en pacientes con un alto riesgo de complicaciones y, además, sus datos más recientes confirman que el medicamento es un “inhibidor potente” ante la variante Ómicron.
Ómicron ya es la variante que más contagia en EEUU; Israel reporta su primera muerte
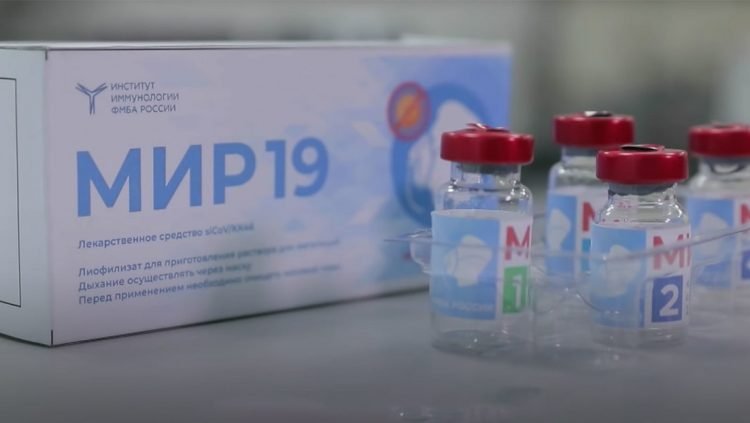
Mientras, el ministerio ruso de Salud ha registrado el medicamento MIR-19 contra el coronavirus, desarrollado por la Agencia Federal de Biomedicina de Rusia (FMBA), según informó el servicio de prensa de la agencia y citados por el sitio web de RT.
MIR-19 es un antídoto contra el coronavirus cuya acción se basa en el bien estudiado mecanismo de interferencia de ARN. El fármaco consta de dos componentes: ARN pequeños de interferencia (siRNA, por sus siglas en inglés) —que son el principio activo del medicamento— y el péptido portador, apunta el citado medio.
“Se ha establecido la identidad completa del MIR-19 y el objetivo en el genoma de todas las líneas de virus conocidas, incluido el ómicron. No se ha identificado ni una sola mutación, lo que hace que el fármaco sea universal contra las diferentes variantes del SARS-CoV-2”, comentó Veronika Skvortsova, jefa de la FMBA, de acuerdo con RT.
Según indican desde la FMBA, durante los experimentos la fórmula se reveló capaz de reducir 10.000 veces la concentración del virus en el organismo.
Apunta la fuente que “gracias al MIR-19, se alivia la enfermedad que puede causar el virus”. Sus creadores aseguran que cuanto antes comience la toma del medicamento, mejor se restablecerá la salud del infectado. Asimismo, precisan que la mayor eficacia se alcanza en los primeros tres días después del contagio.
El antídoto se administra a través de inhalación, por lo que se introduce directamente en el tracto respiratorio, que es el principal objetivo del virus, no afecta al genoma humano y es “absolutamente seguro” para los pacientes, concluye el comunicado de la FMBA.
(Con información de EFE y RT)