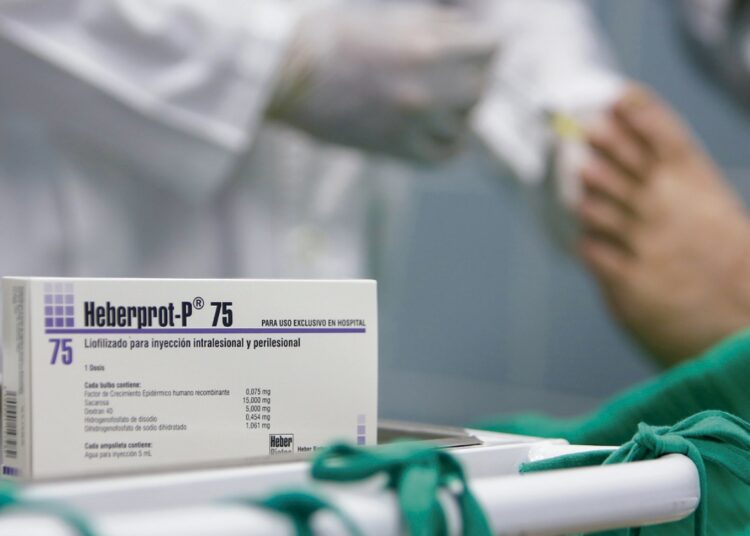
Hace unos días, la Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés), autorizaba a la empresa Discovery Therapeutics Caribe. LLC a realizar en territorio estadounidense un ensayo clínico fase 3 con el fármaco cubano Heberprot-P.
Se tratará, de acuerdo con la nota, de un estudio aleatorizado. Los participantes se distribuirán aleatoriamente en dos grupos a los que se les administrarán 75 mg de Heberprot-P o un placebo, es decir, una sustancia que carece de acción terapéutica. Ni los participantes ni los investigadores conocerán qué se le estará administrando a cada paciente en particular, por eso se dice que el estudio será conducido a “doble ciego”. Cumplido el tiempo del protocolo se compararán los resultados de ambos grupos.
Este tipo de estudios se realiza una vez que ya se conoce sobre la seguridad y efectividad de un fármaco, y se desea probar en grandes grupos poblacionales o introducirlo en un mercado, en este caso, el estadounidense.
Una Mipyme en Cleveland, Ohio
De acuerdo con su página web, DTC es una pequeña empresa asentada en Cleveland, Ohio. Se define a sí misma como una corporación biotecnológica de “etapa tardía” con “socios globales”. Está “comprometida con terapias avanzadas pioneras para los americanos que batallan con las úlceras del pie diabético”, de acuerdo con la misma fuente.
DTC no va a crear ningún medicamento pionero o una terapia innovadora para combatir esta dolencia. Su cometido, que también resulta lícito, es viabilizar la entrada del Heberprot-P al mercado estadounidense. Para eso tiene un acuerdo de licencia exclusiva que le permite comercializar el Heberprot-P con la parte cubana, el Centro de Ingeniería Genética y Biotecnología (CIGB).
Para lograr eso, DTC está siguiendo lo que se conoce como solicitud de licencia biológica (Biologics License Application (BLA)) bajo la provisión 351(a) de la Ley de Servicio de Salud Pública (Public Health Service-PHS Act). Se trata de la vía tradicional para aprobar productos biológicos innovadores en ese país.
La solicitud debe contener toda la información relativa a la seguridad y efectividad del fármaco que se desea probar, en este caso el Heberprot-P. Esa etapa ya está vencida y ahora le corresponde a la empresa desarrollar una serie de estudios que demuestren la efectividad y seguridad del producto, antes de obtener la licencia para comercializarlo en los Estados Unidos.
Esto es posible de acuerdo con lo dispuesto en la Sección 515.547 del Reglamento de Control de Activos Cubanos, que autoriza a “las personas sujetas a la jurisdicción de los Estados Unidos” a involucrarse en todo tipo de transacciones conjuntas para proyectos de investigación médica con nacionales cubanos y todo lo relativo a la comercialización, venta y distribución de estos productos en territorio estadounidense, por supuesto, cumpliendo un grupo de estrictas condiciones.
Esto último implica la aceptación por parte de las autoridades de Estados Unidos de la calidad de la industria biotecnológica cubana y sus productos, lo cual está, lógicamente, en el mejor interés de los ciudadanos de ese país.
Eso no significa, no obstante, que los productos biotecnológicos desarrollados en la isla tengan la puerta abierta en ese mercado; se trata de una pequeña ventana entreabierta.
La empresa tiene cuatro rostros visibles: su presidente y cofundador es Lee C. Weingart, abogado del estado de Ohio, que también fundó hace más de veinte años LNE Group, una “firma de defensa y presión”, lo que se conoce comúnmente como un lobbying firm.
Este tipo de firmas se dedica a la defensa de los intereses de grupos y empresas ante funcionarios gubernamentales, para influir en la adopción de políticas públicas, reglamentos y leyes, algo perfectamente legal y común en Estados Unidos.
También la conforma Jason M. Smith, en carácter de cofundador y vicepresidente, quien se encarga, entre otras cosas, de los asuntos legales y regulatorios, así como de las relaciones con la parte cubana.
La parte médica del emprendimiento corre a cargo del Dr. Milton Sánchez-Parodi, médico de origen cubano graduado en la Facultad de Medicina de la Universidad de Granada, con más de treinta años de experiencia en diversos campos de la medicina.
Por último, como directora de Operaciones Clínicas de DTC, está Deirdre Kraimer. Es graduada en química por la Universidad de Connecticut y tiene un máster en biología por la Universidad de Brown, ambas en el país norteño. La señora Kraimer, según la información pública de la empresa, tiene más de 25 años de experiencia en investigaciones clínicas. Ella será la responsable de diseñar el ensayo clínico con Heberprot-P
La diabetes en el mundo y en Estados Unidos
Es muy difícil que no tengamos un conocido o familiar que la padezca. De acuerdo a la novena edición del atlas de la Federación Internacional de Diabetes, referente a 2019, estamos hablando de una enfermedad grave y crónica que aparece cuando el organismo no puede producir insulina, la produce en cantidad insuficiente o no puede utilizarla eficazmente, por distintos motivos. Las principales categorías de diabetes son: tipo 1, tipo 2, y la diabetes mellitus gestacional.
Los primeros registros de esta enfermedad datan de 1500 años A.C., los médicos indios solían llamarla madhumeha, lo que significa “orina de miel” y describieron las diferencias entre las dos formas de presentación más importantes.
En el siglo II se le designa como “diabetes”, en Grecia, a la patología que aquejaba a las personas que orinar con frecuencia. Diabetes significa “sifón” o “pasar a través de…” y es que los griegos pensaban que las carnes discurrían a través de la orina y por eso los enfermos se demacraban.
En 1674, el médico inglés Thomas Willis designa a la diabetes mellitus como una variante de diabetes en la que la orina tiene un color amarillento, como una “disolución de miel en una gran proporción de agua”, añadiendo entre sus características que es “más o menos dulce al paladar”.
Como sea, se trata de una enfermedad que afecta alrededor de 463 millones de personas entre los 20 y 79 años, lo que representa una prevalencia del 9.3 % entre la población mundial, de acuerdo con un artículo publicado en Pubmed Central. Adicionalmente, se espera que esta cifra aumente a 578 millones para el año 2030 y a 700 millones para 2045.
Según la OMS, en 2019 1.5 millones de personas murieron como consecuencia directa de la enfermedad, de los cuales el 48 % tenía menos de 70 años. Además, a causa de la nefropatía diabética fallecieron otras 460 mil personas y se calcula que la hiperglucemia, uno de los signos de la enfermedad, provocó alrededor del 20 % de las muertes de origen cardiovascular. Se trata, con justicia lo decimos, de una pandemia.
En Estados Unidos, el mercado que pretende conquistar el Heberprot-P, hay 38.4 millones de personas diabéticas, es decir, el 11.6 % de la población de ese país, que también tiene a 8.7 millones todavía esperando por diagnóstico, de acuerdo con un reporte del Centro para el Control y Prevención de Enfermedades (CDC, por sus siglas en inglés).
Adicionalmente, 97.6 millones de personas mayores de 18 años en ese país se consideran prediabéticos y la tendencia es que estas cantidades sigan aumentando.
¿Qué es el pie diabético y cuál es su impacto en la salud global?
La diabetes, como se sabe, puede provocar daños en múltiples órganos y sistemas que incluyen el corazón, los riñones, los ojos, los nervios y el sistema vascular.
Una complicación frecuente y temible de la enfermedad es la úlcera del pie diabético (UPD). Esta afecta al 6.3 % de los enfermos, de acuerdo con un artículo aparecido en la revista Word Journal of Diabetes en diciembre de 2022. Se entiende por UPD a los síntomas que incluyen “el agrietamiento, ulceración, infección o destrucción del tejido del pie” en pacientes diabéticos, de acuerdo con esa fuente.
Se trata de un fenómeno multifactorial que en el mundo occidental es la causa de más del 60 % de las amputaciones no traumáticas. Además, es responsable de un considerable incremento de las tasas de hospitalización y mortalidad en estos enfermos y de una significativa reducción de la calidad de vida de estas personas.
El tratamiento estándar de la enfermedad incluye la descarga de presión de la zona de la herida (básicamente no apoyar la extremidad lesionada); la aplicación de solución salina y el vendaje para proveer un entorno húmedo de la zona; el desbridamiento, que consiste en la eliminación del tejido muerto o dañado para favorecer la cicatrización, también se aplica cuando es necesario.
También incluye el tratamiento con antibióticos y la cirugía, en caso de infección. Esto se une al estricto control de la glucemia y la corrección de la insuficiencia vascular periférica, es decir, la enfermedad que se caracteriza por la disminución del flujo de sangre en las extremidades y que resulta común en los pacientes diabéticos.
Entre los tratamientos innovadores para la úlcera están los cultivos de células humanas, la aplicación de oxígeno hiperbárico, es decir, a altas presiones, y el uso del factor de crecimiento recombinante humano (R-EGF, por sus siglas en inglés) que es el principio activo del Heberprot-P.
En este contexto y dada la alta incidencia de la enfermedad en el mundo, es obvio que exista un gran interés en el medicamento producido en la isla. Heberprot-P reduce la incidencia de amputaciones y promueve la cicatrización, que es la meta dorada en este tipo de pacientes.
Uno de los medicamentos estrella de la Biotecnología cubana
La historia del Heberprot-P se remonta a los años sesenta del pasado siglo, cuando el futuro ganador del Premio Nobel de Medicina y Fisiología en 1986, Stanley Cohen, aisló en las glándulas submaxilares de un ratón macho una proteína capaz de estimular el crecimiento celular. La llamó Factor de Crecimiento Epidermico (EGF, por sus siglas en inglés).
Durante la década del 70, el EGF fue encontrado en diversos líquidos corporales humanos y, una década después, específicamente en 1988, Cuba se convertía en uno de los primeros países del mundo en obtenerlo artificialmente por métodos recombinantes, lo que le agrega la inicial R a las siglas originales: R-EGF. Esto posibilitó que se desarrollaran una serie de investigaciones en las que esta molécula fue protagonista.
“El padre del Heberprot-P”, el Dr. Jorge Berlanga Acosta, en 1994 se encontraba investigando la regeneración de los nervios. Sin embargo, al leer el trabajo de un grupo británico se entusiasmó, pues ellos habían demostrado que inyectar el EGF podía prevenir la muerte celular.
En los primeros momentos se pensó que la aplicación superficial de EGF sería suficiente para que surtiera efecto. Lo que descubrieron los ingleses y que motivó al científico cubano fue la necesidad de inyectarlo de manera específica para que se pudieran obtener los resultados deseados.
Ese momento puede considerarse el punto de partida del Heberprot-P. Por supuesto, nada es fruto de la casualidad, sino del talento y el trabajo duro del investigador y de su equipo, quienes durante siete años desarrollaron una serie de investigaciones en ratas y cerdos con resultados muy alentadores en el campo de la cicatrización. Estas consistían básicamente en provocar heridas en los animales y luego administrar el medicamento para estudiar su efecto.

A inicios de los 2000, el doctor Berlanga y su equipo dieron el salto a las investigaciones en humanos. De esta forma, el EGF se probó en distintas patologías, como la cistitis hemorrágica luego del trasplantes de médula ósea y también en pacientes con colitis.
Sin embargo, debió hacerse evidente el enorme potencial de esta molécula en los pacientes diabéticos, porque desde 2006 se comenzaron a publicar investigaciones en las cuales se demostraba el beneficioso efecto de la infiltración intralesional, es decir, inyectar el EGF dentro de la UPD, para prevenir la amputación en 6 de cada 10 pacientes que presentaban la enfermedad del pie diabético, particularmente en enfermos graves.
Desde que en 2006 el Heberprot-P obtuvo su primer registro sanitario, la licencia para utilizarse en Cuba, hasta la fecha, ha sido aprobado en otros 26 países, donde se ha aplicado a más de 390 mil personas, de acuerdo a un artículo aparecido en la Revista Cubana de Salud Pública.
Es muy significativo que un producto tan novedoso, único en su tipo y que ha demostrado ser eficiente, no haya llegado hasta ahora al mercado estadounidense, donde la diabetes tiene una alta prevalencia.
Heberprot-P en Estados Unidos, una historia difícil
Evidentemente, su ausencia en ese mercado no ha sido fruto del desconocimiento de las potencialidades del fármaco. Desde hace más de una década el Heberprot-P es conocido en aquel país. De hecho, el congresista Joe García, quien abogó a favor de la comercialización de este producto en su país, fue duramente criticado por políticos y medios de derecha.
Por otro lado, tampoco es la primera vez que una empresa estadounidense intenta atravesar la enmarañada selva de prohibiciones del Reglamento de Control Activos Cubanos (CACR, por sus siglas en inglés) con el objetivo de comercializar el Heberprot en ese país.
Desde 2015, una empresa llamada Mercurio Biotec comenzó a hacer gestiones con este fin, las que incluyeron numerosas reuniones en Washington D.C. y en la Habana. En 2018, esas negociaciones llegaron a lo que parecía ser un buen término, materializado en un acuerdo con la compañía cubana Heber Biotec S.A. Esto se consideró histórico en el contexto de las muy viciadas relaciones entre los dos países.
Aquel acuerdo fue profusamente reportado por la prensa, sin embargo, las cosas no llegaron a un final feliz.
Es importante recordar que, luego del tímido deshielo del final de la administración Obama, las relaciones entre los dos países cayeron a su punto más bajo en décadas, y luego llegó la pandemia. El acuerdo entre Heber Biotec S.A. y Mercurio Biotec fue una de las víctimas de estas circunstancias.
Resulta curioso que el entonces presidente de Mercurio Biotec fuera el Dr. Milton Sánchez-Parodi, quien ahora es el responsable de la parte médica por la colaboración entre DTC.LLC y el CIGB, recién anunciada. El Dr. Sánchez-Parodi da continuidad a los esfuerzos por llevar el Herberprot-P al mercado estadounidense.
También es válido señalar que la aprobación de los ensayos clínicos por parte de la agencia reguladora de Estados Unidos, la FDA, no significa que el reinicio de este esfuerzo se haya intentado solo ahora. Desde el primer trimestre de este año la empresa había solicitado la autorización.
De acuerdo con un reporte de Prensa Latina, el estudio debe durar unos 18 meses e incluirá alrededor de “180 pacientes en unos 25 centros” del país. Adicionalmente, se espera que el producto cubano esté en el mercado “a mediados de 2028”, según esa fuente.
Esto significaría un alivio para los 160 mil estadounidenses que cada año son amputados por esta causa, de los cuales 80 mil mueren en los cinco años siguientes a la amputación, lo que convierte a la UPD en una de las primeras causas de muerte en Estados Unidos, incluso por encima de algunos tipos de cáncer.
El éxito de la colaboración que muchos esperamos resultaría un hito en las relaciones entre los dos países y una esperanza renovada para muchos pacientes.